טיטור (בלועזית: טיטרציה; באנגלית: Titration) היא שיטה לקביעת הריכוז של חומרים שונים בתמיסה. בעברית התהליך מכונה "תהליך סתירה".
החומר שאת ריכוזו בתמיסה רוצים לגלות נקרא אנליט (באנגלית: Analyte) והוא מצוי בתמיסה בריכוז לא ידוע. לתוך תמיסת הנעלם מוסיפים תמיסה של חומר בריכוז ידוע וקבוע. חומר זה נקרא טיטרנט (Titrant). בין החומרים מתרחשת תגובה וכל עוד בתמיסה יש שיירים של האנליט התגובה תצא לפועל.

מקובל להשתמש באינדיקטור לזיהוי הנקודה שבה התגובה הסתיימה (לא נותרו עוד שיירי אנליט). בנקודה זו, המכונה "נקודת סוף טיטרציה", ניתן לחשב את ריכוז הנעלם על ידי מציאת כמות המולים שהגיבו מתוך ידיעת הנפח והריכוז המדויקים של הטיטרנט.
טיטרנט - חשוב כי תמיסת הטיטרנט תהיה בעלת ריכוז ידוע בדיוק רב, ושריכוז זה לא ישתנה (לא תהיה שקיעה של החומר, חמצון באוויר וכו') לשם כך נהוג להשתמש בחומר העונה על הקריטריונים של "סטנדרט ראשוני".
ישנן כמה תכונות שנדרשות מהסטנדרט הראשוני:
· בעל מסה מולקולארית גבוהה (כדי להקטין את השגיאה היחסית בשקילתו).
· יציב בתנאי המעבדה (לא סופח לחות (לא היגרוסקופי), שלא יתחמצן באוויר, נוח לאחסון, חיי מדף ארוכים).
· זול.
· מומס היטב במדיום הנבדק (לרוב מים).
· מגיב במהירות ובשלמות עם האנליט.
· טהור.
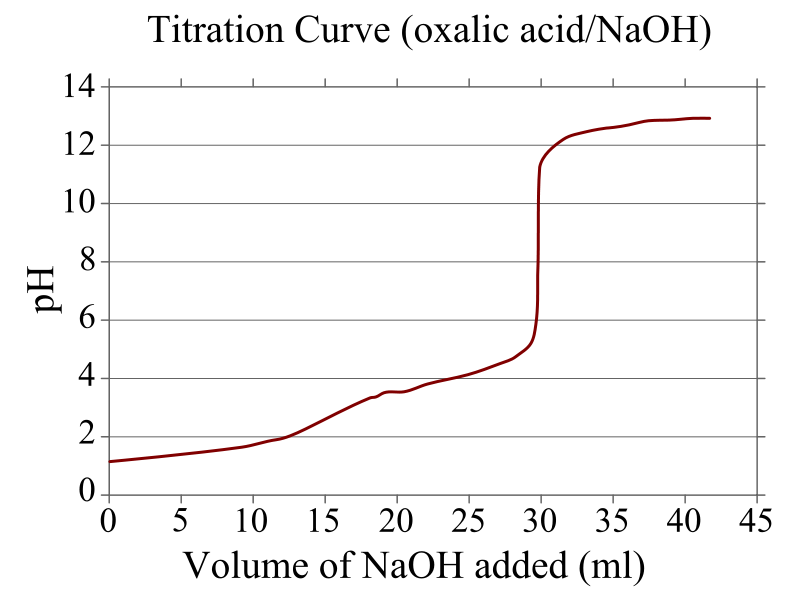
עקומת טיטרציה
בתחילת הטיטרציה ריכוז האנליט בתמיסה יורד לאט מאוד, לאחר מכן מתחילה "צניחה" שנהיית תלולה יותר ויותר ככל שמתקרבים לנקודת שיווי משקל(נקודה האקוויוולנטית). בנקודה האקוויוולנטית תהיה בגרף הפונקציה נקודת פיתול (הנקראת נקודת שקילות). לאחר הירידה התלולה בריכוז האנליט תהיה דעיכה איטית וריכוז התמיסה האנליטית שואף ל-0 כאשר ציר ה-x שואף לאינסוף.